مقاله استروئیدهای آنابولیک–آندروژنیک عملکرد و خطرات

?Anabolic-androgenic steroids: How do they work and what are the risks
.doi: 10.3389/fendo.2022.1059473. eCollection 2022
«برای مشاهده اصل مقاله اینجا کلیک کنید.»
مقدمه مقاله استروئیدهای آنابولیک–آندروژنیک (AAS)
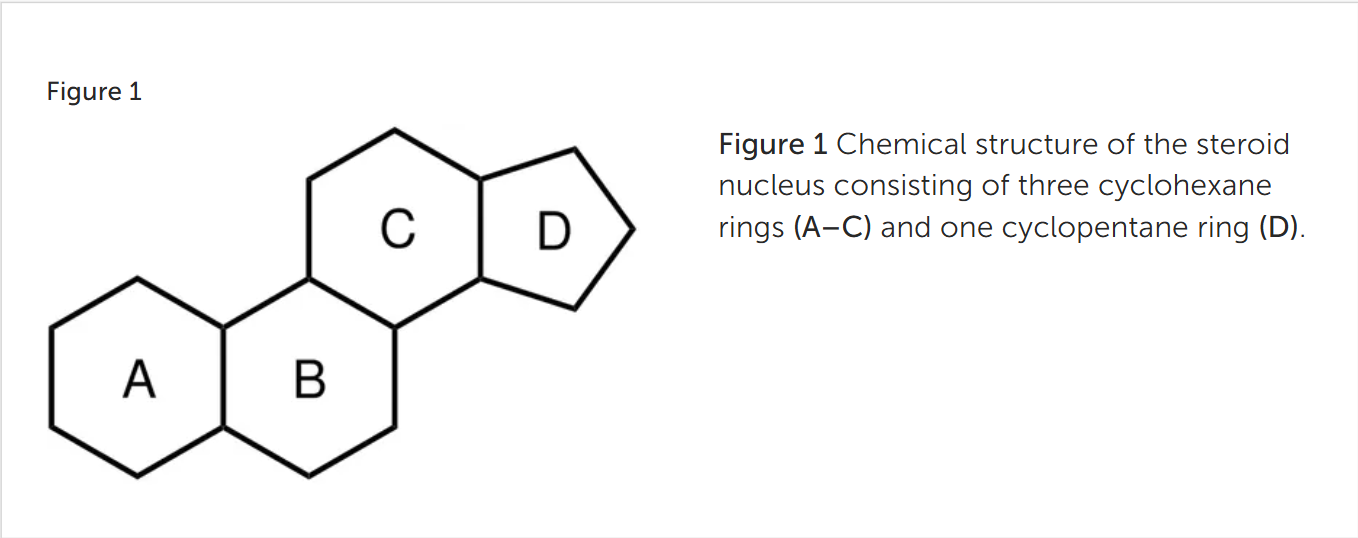
استروئیدهای آنابولیک–آندروژنیک (AAS) گروهی از هورمونهای طبیعی و سنتتیک هستند که نام آنها از ساختار شیمیاییشان (هسته استروئیدی، شکل ۱) و اثرات بیولوژیکی (آنابولیک و آندروژنیک) که ایجاد میکنند گرفته شده است.
- واژه آنابولیک به خاصیت عضلهسازی و تقویت بافت اسکلتی اشاره دارد.
- واژه آندروژنیک به القا و حفظ ویژگیهای جنسی ثانویه مردانه مربوط میشود (که در اصل، خاصیت آنابولیک را هم دربر میگیرد و از این نظر یک اصطلاح متناقض به نظر میرسد).
تستوسترون اصلیترین هورمون درونزاد این گروه محسوب میشود. این هورمون در پزشکی، بهویژه در شکلهای استریشده، برای درمان جایگزینی در هیپوگنادیسم مردان به کار میرود. همچنین تستوسترون و تعداد محدودی از استروئیدهای آنابولیک دیگر مانند ناندرولون و اکساندرولون ممکن است برای برخی بیماریهای دیگر (مانند پوکی استخوان یا آنمی آپلاستیک) نیز تجویز شوند.
اما فراتر از این استفادههای درمانی معتبر، استروئیدهای آنابولیک–آندروژنیک بهطور گسترده – و در واقع به شکل سوءمصرف – برای اثرات عضلهسازی و افزایش قدرت در دوزهایی بسیار بالاتر از دوزهای درمانی استفاده میشوند.
برای سادهسازی، در ادامه این مرور علمی از اصطلاح «مصرف AAS» بهعنوان اشاره به سوءمصرف غیرپزشکی و با دوز بالا این ترکیبات استفاده خواهیم کرد.
استروئیدهای آنابولیک–آندروژنیک (AAS) بهراحتی از طریق فروشندگان محلی یا اینترنت قابل دسترسی هستند، هرچند تجارت آنها – و گاهی حتی مصرفشان – در بسیاری از کشورها غیرقانونی است. با توجه به برآوردها، شیوع مصرف این مواد در طول عمر افراد در سطح جهان حدود ۳.۳٪ است (۶.۴٪ در مردان و ۱.۶٪ در زنان). به همین دلیل تقریباً هر پزشک در طول دوران کاری خود احتمالاً با بیماری مواجه خواهد شد که از AAS استفاده کرده است. البته لزوماً این بیماران مصرف خود را افشا نمیکنند یا ممکن است به دلیل عوارض جانبی آن مراجعه نکنند.
با توجه به خطرات بهداشتی مرتبط با مصرف AAS و میزان شیوع بالای آن، ضروری است که پزشکان – بهویژه پزشکان عمومی، متخصصان غدد، پزشکان پزشکی ورزشی و همچنین پزشکان حوزه اعتیاد – دانش کافی درباره مصرف AAS و عوارض بالقوه آن داشته باشند تا بتوانند مراقبت مناسبی ارائه دهند و ارتباط مؤثری با این گروه از بیماران برقرار کنند.
این مقاله مروری، یک بررسی جامع از فارماکولوژی پایهای و عوارض جانبی این دسته از هورمونها ارائه میدهد. در طول متن، به گزینههای درمانی برای برخی از عوارض اشاره میشود؛ اما این موارد بهعنوان توصیههای قطعی پزشکی مطرح نشدهاند، بلکه بیشتر بازتابی از شیوههای خوددرمانی مصرفکنندگان AAS یا یافتههای موجود در منابع علمی هستند.
همچنان این موضوع محل بحث است که آیا پزشکان باید بهطور مستقیم عوارض ناخواسته ناشی از مصرف AAS را درمان کنند یا خیر. بدیهی است که قطع مصرف AAS بهترین راهحل برای تقریباً تمام عوارض خواهد بود. این هدف میتواند از طریق آموزش بیماران درباره خطرات بالقوه و همچنین پرداختن به مسائل روانی که منجر به ادامه مصرف میشوند (مانند بدریختانگاری بدن یا اعتیاد)، دنبال شود.
با این حال، اگر بیمار تمایلی به قطع مصرف نداشته باشد، پزشکان میتوانند مانند رویکردهای متداول در مواجهه با سیگاریها یا افراد الکلی، درمانهایی را برای کاهش آسیب در نظر بگیرند.
از مصرف تا اثرگذاری
استروئیدهای آنابولیک–آندروژنی (AAS) معمولاً به دو روش مصرف میشوند: تزریق عضلانی (i.m.) یا مصرف خوراکی.
فرمولاسیونهای AAS برای تزریق عضلانی معمولاً بر پایه روغنهای گیاهی (مثل روغن بادامزمینی arachis oil) تهیه میشوند که در آنها AAS حل شده است. به این ترکیبات، اغلب موادی مانند بنزیل بنزوات (BB) یا بنزیل الکل (BA) هم اضافه میکنند؛ این مواد هم خاصیت باکتریاستاتیک دارند (جلوگیری از رشد باکتری) و هم حلالیت AAS را در روغن افزایش میدهند.
بعد از تزریق، یک مخزن روغنی (oil depot) داخل بافت عضله ایجاد میشود که در امتداد فیبرهای عضلانی پخش میشود – به شکلی که انگار بین آنها فشرده شده باشد – و حالتی کشیده پیدا میکند. سپس AAS به تدریج از این مخزن روغنی به مایع میانبافتی (interstitial fluid) آزاد میشود.
سرعت این فرایند به شدت تحت تأثیر گروه اسید کربوکسیلیک متصل به مولکول اصلی در کربن شماره 17 هسته استروئیدی است. این فرآیند که استریفیکاسیون (esterification) گروه 17β-هیدروکسیل نام دارد، با افزایش ضریب تقسیم (lipophilicity بیشتر و hydrophilicity کمتر)، آزادسازی ترکیب از مخزن روغنی را بهطور قابل توجهی کند میکند.
برای مثال:
- تستوسترون خالص (بدون تغییر) پس از تزریق، نیمهعمری در حدود ۱۰ دقیقه دارد.
- اما وقتی با یک اسید کربوکسیلیک ۳ کربنه (پروپیونات) در موقعیت 17β استریفیه شود، نیمهعمرش به حدود ۱ روز میرسد.
- در حالی که استریفیکاسیون با یک اسید کربوکسیلیک ۷ کربنه (انانتات) نیمهعمر را به حدود ۴.۲ روز افزایش میدهد.
عوامل دیگری مثل محل تزریق و حجم تزریق نیز میتوانند بر فارماکوکینتیک تأثیر بگذارند.
در نهایت، وقتی مولکول استریشده وارد گردش خون سیستمیک میشود – چه از طریق انتشار مستقیم و چه از راه تخلیه لنفاوی مایع میانبافتی – آنزیمهای استراز (esterases) گروه استر را جدا کرده و ترکیب اصلی (ماده فعال) آزاد میشود.
استروئیدهای آنابولیک–آندروژنی (AAS) خوراکی به سرعت از دستگاه گوارش (GI) جذب میشوند و غلظت خونی آنها معمولاً ۱ تا ۲ ساعت پس از مصرف متیلتستوسترون به اوج میرسد.
AAS جذبشده از طریق ورید پورتال وارد کبد میشوند. اگر تغییرات ساختاری برای مقاومت در برابر متابولیسم عبور اول (first-pass metabolism) صورت نگرفته باشد، بخش زیادی از AAS جذبشده قبل از خروج از کبد و ورود مجدد به گردش خون، متابولیزه میشوند. این موضوع بهشدت فراهمی زیستی (bioavailability) خوراکی را کاهش میدهد.
برای نمونه:
- بعد از مصرف خوراکی ۲۵ میلیگرم تستوسترون، کمتر از ۱ میلیگرم (حدود ۴٪) در دسترس سیستمیک قرار میگیرد.
برای افزایش فراهمی زیستی خوراکی، یکی از راهها این است که مولکول اصلی را با فرآیند استریفیکاسیون (esterification) محلولتر در چربی کنند. این تغییر باعث میشود بخش بیشتری از AAS جذبشده از طریق سیستم لنفاوی وارد بدن شود و از متابولیسم عبور اول در کبد بگذرد.
با این حال، حتی پس از استریفیکاسیون تستوسترون با یک گروه اسید کربوکسیلیک ۱۱ کربنه (آندکانوات)، فراهمی زیستی خوراکی همچنان پایین و حدود ۶/۸٪ باقی میماند. علاوه بر این، این فرمولاسیون اختلاف زیادی در جذب بین افراد مختلف و حتی در یک فرد در شرایط مختلف نشان میدهد، که استفاده از آن را برای درمان جایگزینی (replacement therapy) دشوار میکند.
برای حل این مشکل، اخیراً تستوسترون آندکانوات در یک سیستم جدید دارورسانی به نام Self-Emulsifying Drug Delivery System (SEDDS) فرموله شده است. این فناوری باعث افزایش جذب لنفاوی و کاهش اختلافات فردی در فراهمی زیستی میشود. سازمان FDA این فرمولاسیون (با نام تجاری JATENZO®) را در سال ۲۰۱۹ تأیید کرد. البته برای حفظ سطح فیزیولوژیک تستوسترون در طول روز، باید دو بار در روز مصرف شود.
یک راهکار جایگزین دیگر این است که متابولیسم ترکیب را بهشدت کند کنند. این کار با متیلاسیون در موقعیت 17α روی مولکول اصلی انجام میشود. این تغییر ساختاری باعث افزایش قابل توجه فراهمی زیستی خوراکی میشود، اما مشکل مهمی که دارد این است که میتواند مسمومیت کبدی (hepatotoxicity) ایجاد کند.
وقتی استروئیدهای آنابولیک–آندروژنی (AAS) وارد گردش خون سیستمیک میشوند، به پروتئینهای ناقل (binding proteins) متصل شده و به بافتها منتقل میشوند. مهمترین این پروتئینها عبارتند از:
- آلبومین (Albumin)
- گلوبولین متصلشونده به هورمونهای جنسی (SHBG: Sex Hormone-Binding Globulin)
- گلوبولین متصلشونده به کورتیکواستروئیدها (CBG)
- اوروسوموکوئید (orosomucoid)
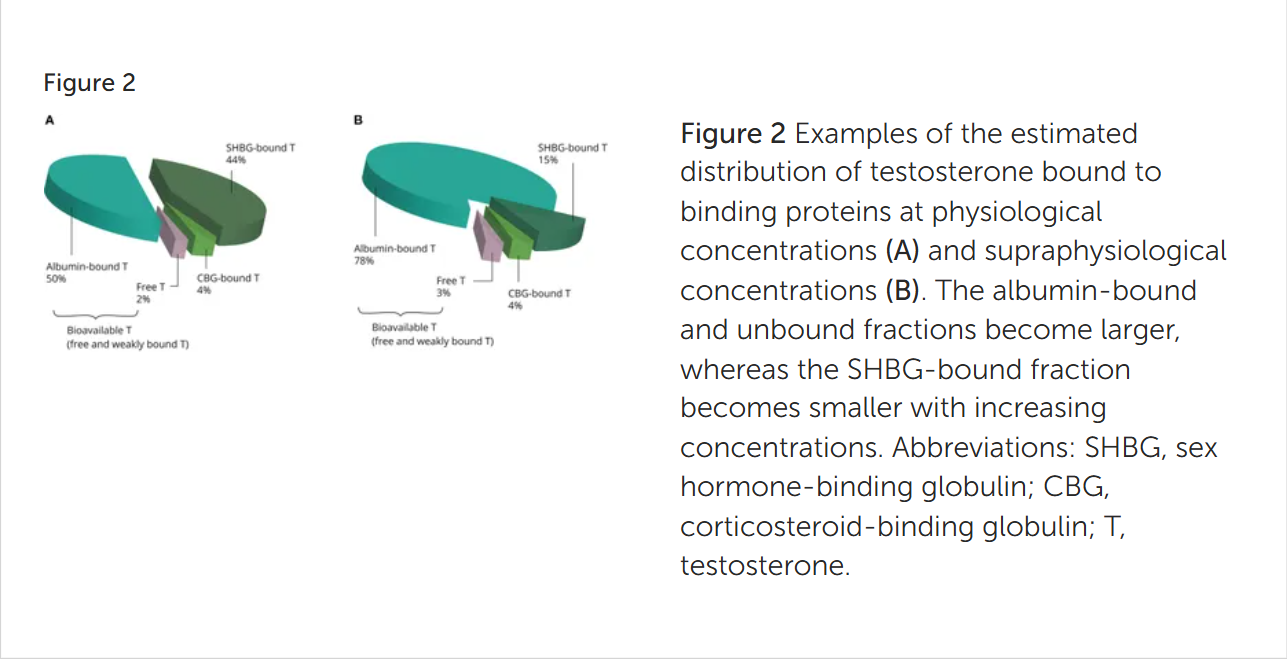
در شرایط فیزیولوژیک (طبیعی)، بیشتر تستوسترون موجود در خون به دو پروتئین اول (آلبومین و SHBG) متصل میشود و تنها ۱ تا ۴ درصد تستوسترون به صورت آزاد (unbound) در گردش خون باقی میماند.
🔹 SHBG تستوسترون را با قدرت اتصال بالا (high affinity) اما با ظرفیت پایین متصل میکند.
🔹 آلبومین برعکس، تستوسترون را با قدرت اتصال پایین ولی با ظرفیت تقریباً نامحدود حمل میکند.
SHBG به صورت یک هومودایمر (دو پروتئین مشابه متصل به هم) در خون وجود دارد که هر مونومر آن یک جایگاه اتصال به استروئید دارد. در شرایط طبیعی، حدود یکسوم جایگاههای اتصال SHBG توسط تستوسترون اشغال میشوند، در حالی که بقیه جایگاهها میتوانند توسط سایر استروئیدها پر شوند. در مجموع، حدود ۴۴ درصد از جایگاههای اتصال SHBG خالی باقی میمانند.
با توجه به اینکه سطح فیزیولوژیک SHBG در محدوده ۱۰ تا ۵۶ نانومول بر لیتر قرار دارد، مشخص است که دوزهای بالای غیرفیزیولوژیک تستوسترون (supraphysiological doses) به سرعت ظرفیت اتصال SHBG را اشباع میکنند. علاوه بر این، این دوزهای بالا موجب کاهش شدید سطح گردش SHBG در خون میشوند. بنابراین، هرچه دوز تستوسترون افزایش یابد، نسبت تستوسترون متصلشده به آلبومین نسبت به SHBG بیشتر میشود (نگاه کنید به شکل ۲ مقاله).
نکته مهم این است که SHBG تمایل بسیار کمی به اتصال به سایر AASهای رایج دارد، مثل:
- ناندرولون (Nandrolone)
- متنولون (Methenolone)
- استانوزولول (Stanozolol)
- متاندیانون (Methandienone)
- فلوکسیمسترون (Fluoxymesterone)
- اکسیمتولون (Oxymetholone)
اگرچه تستوسترون آزاد (Unbound fraction) به تنهایی مسئول تمام اثرات تستوسترون نیست، اما گفته میشود که نسبت به تستوسترون کل، بازتاب دقیقتری از عملکرد آندروژنی سیستمیک است.
سطوح پایین تستوسترون آزاد میتوانند در حضور سطح طبیعی تستوسترون کل با علائم کمبود آندروژن همراه باشند، در حالی که سطوح طبیعی تستوسترون آزاد حتی اگر سطح تستوسترون کل پایین باشد، معمولاً با علائم کمبود آندروژن همراه نیستند.
با این حال، اهمیت نسبی بخش آزاد و بخش متصل تستوسترون همچنان محل بحث است، چرا که شواهد علمی موجود هنوز برای رسیدن به نتیجه قطعی کافی نیست.
از جریان خون، استروئیدهای آنابولیک–آندروژنی (AAS) وارد بخش خارجعروقی شده و به سلولهای هدف خود منتشر میشوند تا اثراتشان را اعمال کنند. پس از عبور از غشای پلاسمایی، AAS میتوانند سه مسیر اصلی را طی کنند:
- تبدیل به یک آندروژن قویتر
- تبدیل به یک متابولیت ضعیفتر یا غیرفعال
- تبدیل به یک استروژن
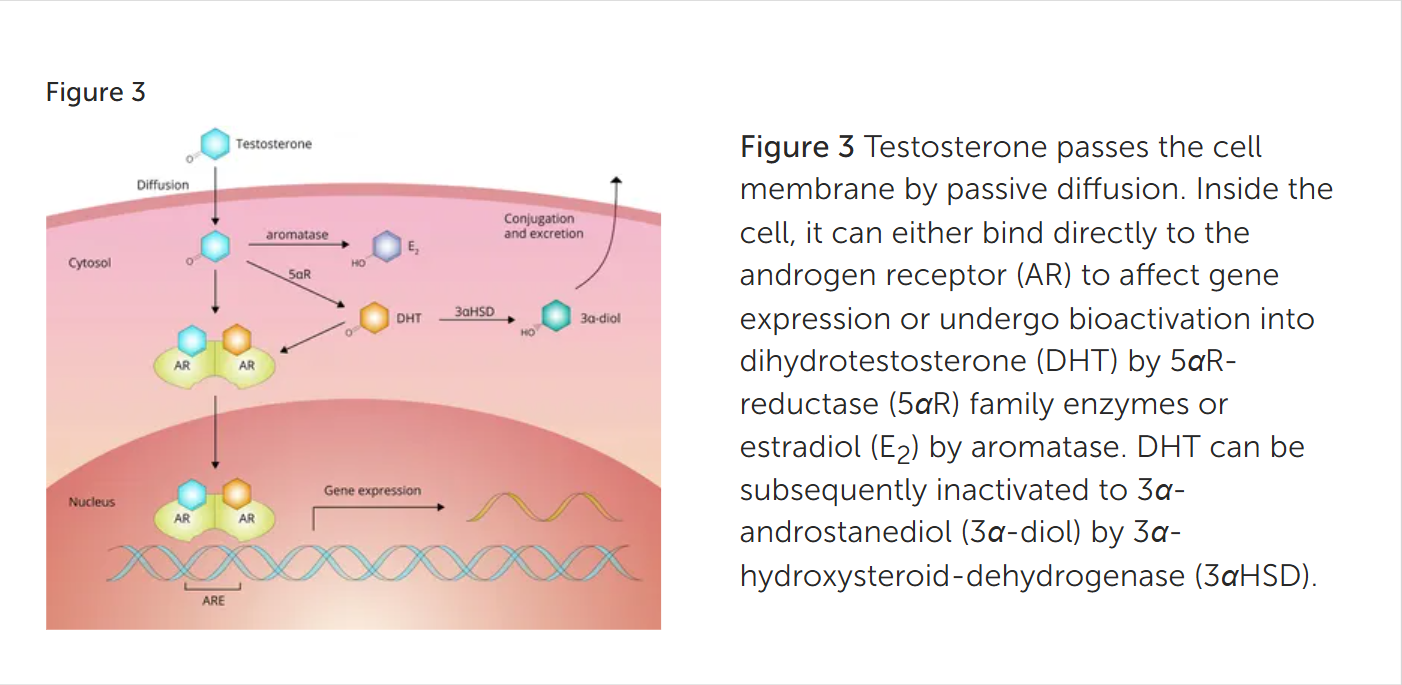
توضیحات شکل:
(تستوسترون از طریق انتشار غیرفعال (Passive diffusion) از غشای سلول عبور میکند. درون سلول، دو مسیر اصلی پیش روی آن وجود دارد:
- اتصال مستقیم به گیرنده آندروژن (AR) و تأثیرگذاری بر بیان ژنها.
- بایواکتیواسیون (فعالسازی زیستی) و تبدیل شدن به:
- دیهیدروتستوسترون (DHT) توسط آنزیمهای خانواده 5αR-reductase (5αR).
- استرادیول (E2) توسط آنزیم آروماتاز (Aromatase).
DHT پس از تشکیل میتواند توسط آنزیم 3α-هیدروکسیاستروئید دهیدروژناز (3αHSD) غیرفعال شده و به ترکیب 3α-آندروستاندیول (3α-diol) تبدیل شود.)
تستوسترون در بافتهایی که آنزیمهای خانواده 5α-ردوکتاز را بیان میکنند، به یک آندروژن قویتر تبدیل (Bioactivation) میشود. این آنزیمها یک واکنش کاهش در کربن شماره ۵ کاتالیز میکنند و یک اتم هیدروژن با جهتگیری آلفا به آن اضافه مینمایند. وقتی تستوسترون بهعنوان سوبسترا وارد این واکنش میشود، محصول آن قویترین آندروژن طبیعی موجود یعنی دیهیدروتستوسترون (DHT) است.
در افراد بزرگسال، این آنزیمها در بافتهایی مانند کبد، پوست، پروستات، اپیدیدیم، وزیکولهای منی، بیضه، کلیه، پانکراس و مغز بیان میشوند.
نکته مهم این است که DHT نقش قابلتوجهی در اثرات عضلهسازی تستوسترون ندارد. سطح DHT در عضله اسکلتی بسیار پایین است، زیرا این بافت به میزان زیادی آنزیم مربوطه را بیان نمیکند. همچنین، به نظر میرسد DHT در عضله اسکلتی توسط آنزیم 3α-هیدروکسیاستروئید دهیدروژناز (3αHSD) غیرفعال شده و به ترکیب 3α-آندروستاندیول تجزیه میشود. در واقع، تغییرات در توده بدون چربی بدن در پاسخ به دوزهای مختلف تستوسترون، تحت تأثیر مهار DHT با داروی مهارکننده قوی 5α-ردوکتاز یعنی دوتاستراید (Dutasteride) قرار نمیگیرند. تبدیل تستوسترون به DHT از کینتیک اشباعشونده مایکلـیس–منتن پیروی میکند و مقدار Km برآوردشده در بدن انسان برابر با 3.35 نانومولار است. جالب است بدانیم که مسیر بایواکتیواسیون به سمت DHT فقط برای تستوسترون رخ میدهد و برای سایر AASهای رایج مشاهده نشده است.
از طرف دیگر، استروئیدهای آنابولیک–آندروژنی (AAS) عمدتاً در کبد و همچنین در کلیهها و سایر بافتهای حساس به آندروژن غیرفعال (Bioinactivated) میشوند. این ترکیبات تحت متابولیسم فاز I و فاز II قرار میگیرند. به طور کلی، در متابولیسم فاز I معمولاً واکنش کاهش در کربنهای ۳ و ۵ حلقه A و واکنش اکسیداسیون گروه هیدروکسیل در کربن ۱۷ حلقه D هسته استروئیدی رخ میدهد. سپس متابولیتهای فاز I ممکن است با گلوکورونیدها کونژوگه شده و از بدن دفع شوند. همچنین مقداری سولفاته شدن هم اتفاق میافتد.
تبدیل به استروژن (Bioactivation into Estrogen)
تبدیل استروئیدهای آنابولیک–آندروژنی (AAS) به استروژن میتواند در مواردی رخ دهد که این ترکیبات بهعنوان سوبسترا برای آنزیم آروماتاز (Aromatase) عمل کنند. این مسیر بهویژه برای تستوسترون اهمیت دارد، چراکه منجر به تولید استرادیول 17β میشود. بیشتر AASهای دیگر سوبسترا برای آروماتاز نیستند یا با سرعت بسیار پایینتری تبدیل میشوند. با این حال، اگر این دسته دوم در دوزهای بالا مصرف شوند، همچنان میتوانند مقدار قابل توجهی استروژن تولید کنند.
استروژنی که به این شکل تولید میشود، با اتصال به گیرندههای استروژنی آلفا و بتا اثرات خود را اعمال کرده و طیف وسیعتری از پیامدهای بیولوژیکی را نسبت به ترکیب اصلی ایجاد میکند. تولید استروژن بهویژه از این نظر اهمیت دارد که میتواند به بروز ژینکوماستی (بزرگ شدن بافت سینه در مردان) منجر شود و همچنین از طریق اثرات بازخورد منفی بر محور هیپوتالاموس–هیپوفیز–گناد (HPGA)، اختلالات هورمونی ایجاد کند.
نقش گیرنده آندروژن (Androgen Receptor)
در حالت بدون لیگاند، گیرنده آندروژن (AR) عمدتاً در سیتوپلاسم قرار دارد و با پروتئینهای شاپرون در ارتباط است. اتصال لیگاند (مانند تستوسترون یا AAS) زنجیرهای از رویدادها را آغاز میکند که شامل:
- انتقال کمپلکس لیگاند–گیرنده از سیتوپلاسم به هسته،
- جدا شدن پروتئینهای شاپرون،
- تشکیل یک هومودایمر که به عناصر پاسخدهنده آندروژن (AREs) در نواحی تنظیمی ژنهای هدف متصل میشود.
ژنوم انسان هزاران جایگاه اتصال AR دارد. با اتصال کمپلکس به این جایگاهها، فرآیند رونویسی ژن تنظیم شده و اثرات آندروژنها اعمال میشود.
علاوه بر این، AAS میتوانند اثرات غیر ژنومی (Nongenomic effects) نیز ایجاد کنند که بخشی از آنها به نظر میرسد از طریق گیرندهای متفاوت از AR انجام شود. یکی از کاندیداهای احتمالی، گیرنده جفتشونده با پروتئین G به نام GPRC6A است. با این حال، اثرات بالینی ناشی از این مکانیسمها هنوز بهطور کامل شناخته نشدهاند.
اثرات بالینی (Clinical Effects)
با وجود ناشناخته بودن برخی مسیرها، اثرات بالینی اصلی AAS کاملاً روشن است:
افزایش توده عضلانی و قدرت بدنی، که دلیل اصلی گرایش کاربران به مصرف این مواد است.
در سال 1996، یک کارآزمایی بالینی تصادفی–کنترلشده توسط باسین (Bhasin) و همکاران نقطه عطفی در این حوزه بود. این مطالعه نشان داد که دوزهای بالای تستوسترون (تا 600 میلیگرم تستوسترون انانتات در هفته) بهطور مؤثر و وابسته به دوز باعث افزایش حجم و قدرت عضلانی در مردان سالم میشود؛ بهویژه زمانی که با تمرینات مقاومتی ترکیب شود.
مطالعات جدیدتر با طراحی علمی دقیق نیز بار دیگر تأیید کردهاند که اثرات عضلهسازی قدرتمند AAS، همان چیزی است که ورزشکاران حرفهای و بدنسازان دهههاست آن را تجربه کردهاند.


دیدگاه خود را بنویسید